Fremdeiweiß und Fremdeiweiß-Hydrolysate in Fleisch und Fleischerzeugnissen
Ein hoher Verarbeitungsgrad und eine komplexe Zutatenliste von Fleischerzeugnissen ermöglichen es generell, hochwertiges Fleischeiweiß teilweise durch häufig preisgünstigeres Fremdeiweiß oder deren Hydrolysate zu ersetzen. Dies kann ökonomisch, jedoch auch technologisch oder sensorisch bedingt sein. Ist die Zugabe von Fremdeiweiß oder Fremdeiweiß-Hydrolysaten nicht deklariert, liegt eine Verbrauchertäuschung vor. Darüber hinaus können Fremdeiweiße Allergien oder Lebensmittelunverträglichkeiten auslösen und stellen somit ein potenzielles Gesundheitsrisiko dar. Als mögliche Fremdeiweißquellen kommen pflanzliche, tierische und weitere Quellen wie Hefen oder auch Bakterien in Betracht. Hierbei sind vor allem der Proteingehalt, die Verfügbarkeit, die Eigenschaften der Proteine und der Preis von entscheidender Bedeutung. Ein Beispiel für eine Fremdeiweißquelle pflanzlichen Ursprungs ist die Getreideschlemme, die bei der Bioethanolproduktion anfällt. Blut hingegen ist ein Schlachtnebenprodukt und könnte als tierische Fremdeiweißquelle verwendet werden.
Die gleichen Fremdeiweißquellen können auch in der Form von Eiweiß-Hydrolysaten Fleisch und Fleischwaren zugesetzt werden. Unter Eiweiß-Hydrolysaten versteht man chemisch oder enzymatisch gespaltene Eiweiße. Hierbei entstehen kurzkettige Peptide und freie Aminosäuren. Das relative Mengenverhältnis zwischen Aminosäuren und Peptiden beschreibt der Hydrolysegrad - der Anteil an gelösten Peptidbindungen in Prozent vom Aufgangsmaterial. Man unterscheidet grundsätzlich zwischen Hydrolysaten, welche nur Aminosäuren enthalten und Hydrolysaten, welche sowohl aus Aminosäuren als auch Peptiden bestehen. Durch die Hydrolyse erhöht sich einerseits die Löslichkeit der Eiweiße in Wasser und zum anderen verringert sich die Gesundheitsgefährdung durch die Zerstörung der Eiweiße.
Unabhängig von der Quelle und der Behandlung der Eiweiße, muss eine Substitution von hochwertigem Fleischeiweiß in allen Fällen analytisch nachweisbar sein. Nur so kann das Unterlassen der Deklaration erfasst, die Gesundheit der Verbraucher geschützt und geltendes Recht durchgesetzt werden. Leider sind die bisher zur Verfügung stehenden Methoden häufig nicht ausreichend oder zu begrenzt in ihrem Anwendungsbereich, woraus sich die Forderung nach der Entwicklung von modernen Methoden ergibt, mit denen ein schneller und gerichtsicherer Nachweis möglich ist. Dabei sollten diese Methoden gleich mehrere Eiweißquellen in einem Ansatz detektieren, um die wiederholte Analyse desselben Produktes auf einzelne Eiweißquellen zu vermeiden. Ein weiteres Kriterium ist die Unempfindlichkeit gegenüber den vielseitigen verwendeten Verarbeitungsverfahren von Fleisch. Einige der gegenwärtig kommerziell erhältlichen Kits beruhen auf antikörperbasiertem Verfahren (ELISA - Enzyme-linked Immunosorbent Assay), bei denen der spezifische Nachweis nur bei gefalteten Eiweißen möglich ist. Bei hochgradig verarbeiteten Lebensmitteln - wie etwa einer Brühwurst, wird unter solchen Umständen die Nachweisbarkeit sehr gering, weil sich die räumliche Struktur des Eiweißes durch Hitzeeinwirkung ändert. Zusätzlich wird bei ELISA nur ein Zielprotein pro Ansatz nachgewiesen. Dies ist ein erheblicher Nachteil in Anbetracht der großen Variabilität der Fremdeiweißquellen.
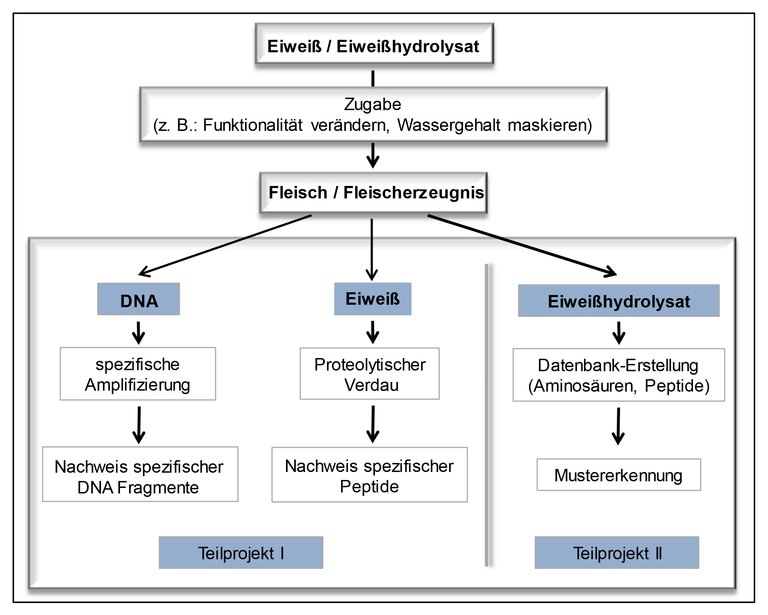
Ziel dieses Projektes ist es daher, schnelle und kostengünstige Nachweismethoden zu erarbeiten, die den Nachweis mehrerer Analyten simultan ermöglichen. Dadurch soll eine Überwachung von Lebensmitteln bezüglich des Zusatzes von Fremdeiweißen oder deren Hydrolysaten gewährleistet werden. Dabei wird der Ansatz verfolgt, die Zugabe von Fremdeiweißen einerseits anhand der korrespondierenden Fremd-DNA und andererseits anhand der Fremdeiweiße selbst nachzuweisen. Der parallele Ansatz hat zum Ziel, systematisch die Vor- und Nachteile beider Methoden – auch im Hinblick auf unterschiedliche Auswirkungen z.B. technologischer Verarbeitungen auf die Nachweisbarkeit von DNA und Eiweißen – evaluieren zu können. Der Einsatz von Hydrolysaten soll anhand der entstandenen kurzkettigen Peptide und Aminosäuren detektiert werden.
Indirekter Nachweis von Fremdeiweiß mittels qPCR
Im Projektteil, der sich mit dem indirekten Nachweis von Fremdeiweiß befasst, liegt der Fokus momentan auf dem Nachweis der DNA Moleküle, die zusammen mit den pflanzlichen Fremdeiweißquellen in Fleischprodukte eingebracht werden. Die Methode der Wahl ist dabei die quantitative Real-time Polymerase-Kettenreaktion (qPCR). Die qPCR-Methodik beruht darauf, dass jede Pflanzen- und Tierart ein einmaliges Erbgut hat. Für jede Art kann ein artspezifisches Nachweissystem etabliert werden, das auf der Vervielfältigung von DNA-Abschnitten beruht. Dabei wird diese Amplifikation der DNA-Abschnitte durch die Messung von Fluoreszenz zeitlich verfolgt. Durch die Verwendung von verschiedenen Fluoreszenzfarbstoffen können simultan mehrere Arten spezifisch detektiert und quantifiziert werden.
Bisher konnten bereits zwei Triplex qPCR Systeme für den simultanen Nachweis von Gerste, Hafer und Roggen bzw. Weizen, Mais und Reis etabliert werden. In Brühwürsten, die mit allen sechs Getreidearten versetzt waren, konnte bis zu einem Zusatz von 0,0005 Gewichtsprozent Fremdeiweißgehalt das jeweilige Getreide selbst in hocherhitzten Tropenkonserven nachgewiesen werden. Die erarbeiteten Methoden können nun für die Untersuchung von Handelsproben eingesetzt werden.
Direkter Nachweis von Fremdeiweiß mittels HPLC-MS/MS
Parallel zu dem indirekten Nachweis wird auch der direkte Nachweis von Fremdeiweiß mittels Hochleistungs-Flüssigkeitschromatographie (HPLC) und Tandem-Massenspektrometrie (MS/MS) etabliert. Ähnlich zur artspezifischen DNA, besitzen die unterschiedlichen Pflanzen und Tiere auch artspezifische Eiweiße. Diese werden nach der Extraktion durch eine enzymatische Spaltung in spezifische Peptide zerlegt. Die Detektion dieser Peptide erfolgt dann mittels HPLC-MS/MS.
Der Nachweis von zugesetzten Eiweißen ist dann besonders problematisch, wenn diese bereits in geringeren Mengen ein natürlicher Bestandteil der Wurst sind. Ein klassisches Beispiel hierzu ist der Zusatz von Blut bzw. Blutplasma, da der Restblutgehalt im Fleisch stark schwankt und somit nur schlecht vorhersehbar ist. Aber auch hier sollte die HPLC-MS/MS die Möglichkeit bieten, die Zugabe von Blutplasma zu erfassen.
Bis jetzt konnten HPLC-MS/MS-Methoden zum simultanen Nachweis von einerseits Molkenproteinen und Casein sowie andererseits von Erbse, Lupine und Soja jeweils in Fleischerzeugnissen erfolgreich entwickelt werden. Außerdem wurde eine weitere Methode zur Bestimmung der Hauptgetreidearten – Gerste, Hafer, Mais, Reis, Roggen, Weizen – in Wurstwaren etabliert, die alle sechs Spezies simultan in nur einer Analyse nachzuweisen vermag. Aufgrund des allergenen bzw. gesundheitsschädlichen Potentials von einigen dieser Analyten wurde hierbei ein Nachweisvermögen kleiner 20 ppm je Fremdeiweiß in Brühwurst angestrebt und erreicht.
Im Zuge der Erarbeitung von Nachweisverfahren wurden auch die Einflüsse von variierenden Herstellungsverfahren, Verarbeitungsvarianten sowie der Lagerung berücksichtigt. Somit können robuste Methoden zur Verfügung gestellt werden, die stets sichere und vertrauenswürdige Ergebnisse liefern.
Nachweis von Fremdeiweiß-Hydrolysaten
Das Nachweisverfahren für die Verwendung von Eiweiß-Hydrolysaten wurde für Putenfleisch entwickelt. Putenfleisch ist in diesem Zusammenhang von besonderem Interesse, da dieses zum einen eine hohe Aufnahmefähigkeit von Wasser besitzt und zum anderen auf Grund der geringen Gewinnmarge besonders für Manipulationen anfällig ist. Darüber hinaus wird es in Deutschland in größeren Mengen verzehrt. Als Hydrolysate werden vor allem Rindercasein und Schweinegelatine verwendet. Der Nachweis erfolgt über freie Aminosäuregehalte mittels Kationenaustausch-chromatographie. Hierzu wird die Verteilung der freien Aminosäuren von unbehandelten Proben mit der Verteilung von Proben, welche mit Eiweiß-Hydrolysaten versetzt wurden, verglichen. Dabei dient die Verteilung der freien Aminosäuren in frischem Putenfleisch als ein Referenzdatensatz. Für die Untersuchungen werden die Fleischproben mit diversen Fremdeiweiß-Hydrolysaten mit unterschiedlichen Hydrolysegraden versetzt. Mit Hilfe der Verteilung der freien Aminosäuren können bis jetzt alle Fremdeiweiß-Hydrolysate mit einem hohen Hydrolysegrad sicher belegt werden. Bei Fremdeiweiß-Hydrolysaten mit geringeren Hydrolysegraden sind gegebenenfalls zu wenige Aminosäuren vorhanden, als dass die Zugabe des Fremdeiweiß-Hydrolysats mit einer Aminosäureanalyse nachgewiesen werden kann. Da dabei aber entsprechend mehr Peptide entstehen, ist ein Nachweis über die Peptidmusteranalytik möglich.