Zelluläre Regulationswege in Pilzen
Was hat Stress mit Mykotoxinen zu tun?
Schimmelpilze sind wichtige Verderbsorganismen von Obst und Gemüse. Es wird geschätzt, dass weit mehr als 25 Prozent der jährlichen Welternte durch Pilzbefall verloren gehen. Erschwerend hinzu kommt, dass viele Schimmelpilzarten in der Lage sind sekundäre Stoffwechselprodukte, wie bestimmte Antibiotika und Giftstoffe (Mykotoxine), zu bilden. Die Mykotoxine Aflatoxin, Alternariol, Tenuazonsäure, Altertoxin, Ochratoxin A, Citrinin und die Trichothecene, die durch verschiedene Aspergillus-, Alternaria-, Penicillium- und Fusarium-Arten gebildet werden, sind für die Lebensmittelsicherheit sehr bedeutsam. Aspergillus-Arten sind an höhere Temperaturen angepasst und daher verantwortlich für das Vorkommen von Aflatoxinen auf Mais, Hirse, Erdnüssen, Pistazien und Trockenfrüchten, sowie Ochratoxin A in Kaffee, Kakao, Gewürzen und Trauben aus südlichen Regionen. Penicillium- und Alternaria-Arten bevorzugen hingegen eher moderate Temperaturen und spielen daher besonders im mittel- und nordeuropäischen Raum als Mykotoxinbildner eine Rolle. Fusarium-Arten sind weltweit verbreitet und an unterschiedlichste Temperaturen angepasst.
Mykotoxine sind als sekundäre Stoffwechselprodukte der Pilze für deren Überleben nicht essenziell und werden daher nur unter bestimmten Bedingungen gebildet. Umfangreiche Untersuchungen am Institut für Sicherheit und Qualität bei Obst und Gemüse zeigten, dass Bedingungen, die für den Pilz Stress bedeuten (z. B. tiefe Temperaturen, geringe Wasseraktivitäten) die Mykotoxinbildung fördern. Diese Tatsache spielt besonders bei der Verarbeitung und Lagerung pflanzlicher Lebensmittel eine Rolle, da ein geringes Pilzwachstum hier nicht immer vollständig ausgeschlossen und somit die Lebensmittelsicherheit beeinträchtigt werden kann.
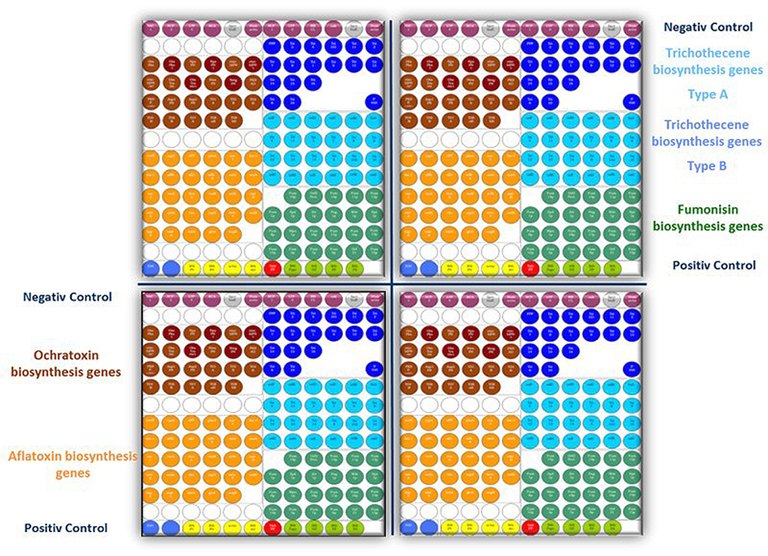
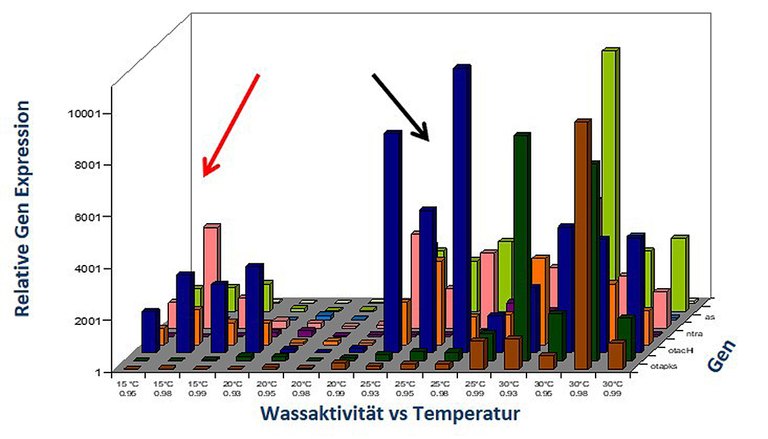
Das Institut für Sicherheit und Qualität bei Obst und Gemüse erforscht daher intensiv den Einfluss von Umweltbedingungen auf die Aktivierung der Toxinbildung. Untersuchungen mittels eines von uns entwickelten DNA-Microarray haben gezeigt, dass äußere Parameter einen starken Einfluss auf die Transkriptionsaktivität, also die Aktivierung von Mykotoxin-Biosynthesegenen haben: Je nach äußerer Bedingung können diese Gene aktiviert (unerwünscht) oder inaktiviert (erwünscht) werden. Dies wurde für pflanzliche Lebensmittel bei unterschiedlichsten Kombinationen an Wachstums- und Lagerungsbedingungen systematisch untersucht. Es wurde unter anderem gezeigt, dass verschiedene Stressfaktoren, wie z. B. Licht, Temperatur, Wasseraktivität, pH-Wert oder Konservierungsstoffe zwar zu einer Reduktion des Pilz-Wachstums, jedoch auch zu einer erhöhten Mykotoxinbildung führen können.
Der Einfluss dieser äußeren Parameter auf die Aktivierung der Mykotoxin-Biosynthesegene erfolgt über bestimmte zelluläre Signalkaskadewege (Abbildung 1). Häufig existiert in der Zellwand bzw. Zellmembran ein Rezeptormolekül (z. B. ein Osmo-Sensor), das Informationen über die Änderung äußerer Parameter an den Zellkern weiterleitet, wodurch Gene aktiviert oder inaktiviert werden können. Bei den Zwischenstufen, von Membransensor bis zur Genregulation, handelt es sich in der Regel um verschiedene hintereinandergeschaltete Kinasen (Mitogen Aktivierte Kinasen, MAP-Kinasen). Eine wichtige Kinase in diesem Regulationsnetzwerk ist die sogenannte HOG-Kinase, die eine große Rolle bei der Antwort der Zelle auf verschiedene Stressfaktoren spielt. Diese Kinase scheint daher zentral an der umweltbedingten Aktivierung der Mykotoxinbiosynthese mitzuwirken. Wenn ihre Funktion genau bekannt ist, können neue Strategien für die Vermeidung der Mykotoxinbildung in Lebensmitteln entwickelt werden. In verschiedenen Projekten (z. B. AflaZ und Alternaria-UBMAL) wird die Rolle der HOG-Kinase und anderen zentralen Elementen von Signal- und Regulationswegen in Pilzen genauer untersucht. Ziel ist es, Möglichkeiten zu finden deren Aktivität zu beeinflussen und damit nachgeschaltete Prozesse wie Pilzwachstum und Mykotoxinbildung. So wurde die HOG-Kinase bereits in Alternariatoxin- und Ochratoxinbildenden Pilzen nachgewiesen und gezeigt, dass eine Phosphorylierung (metabolische Aktivierung) dieser Kinase mit der Mykotoxinbildung zusammenhängt.